病原真菌功能基因组学团队在小麦赤霉菌中发现组蛋白乙酰化动态平衡调控的新机制
近日,New Phytologist在线发表了植保学院病原真菌功能基因组学团队题为“The Fng3 ING protein regulates H3 acetylation and H4 deacetylation by interacting with two distinct histone modifying complexes”的研究论文。学院江聪研究员为通讯作者,博士研究生徐怀键,硕士研究生叶萌、夏阿亮为共同第一作者。
该研究发现生长抑制因子蛋白Fng3通过结合NuA3组蛋白乙酰化复合体以及Rpd3组蛋白去乙酰化复合体以实现H3乙酰化和H4去乙酰化间的动态平衡。研究结果为揭示丝状真菌不同组蛋白修饰间的关系提供了新的视角。
生长抑制因子蛋白家族(INhibitor of Growth, ING)作为重要的一类肿瘤抑制因子在医学研究中受到关注。真菌中对此类蛋白的认知主要来源于酵母,对丝状真菌生长抑制因子蛋白的功能仍知之甚少。该研究鉴定到一个仅在子囊菌中存在的生长抑制因子Fng3。赤霉菌在缺失FNG3后,生长速率减慢、有性发育受阻、致病力和产毒能力严重降低。研究发现,该蛋白通过Nto1与NuA3组蛋白乙酰化复合体核心亚基FgSas3互作,介导对组蛋白H3乙酰化的调控。然而,RNA-seq,ChIP-seq和组蛋白乙酰化分析均表明Fng3在调控H3乙酰化的同时,还参与了对组蛋白H4的去乙酰化调控。这一调控关系的建立依赖于Fng3与去乙酰化复合体核心亚基FgRpd3的互作。有意思的是,研究发现Fng3与酵母的Rpd3并不互作,但是与稻瘟菌、粗糙脉胞菌等丝状真菌的Rpd3同源蛋白则能够互作。序列分析显示,丝状真菌的Rpd3相比酵母多出了一段具有典型无序结构域的碳末端,该无序的碳末端能够形成相分离。相分离现象近年来在动植物研究中逐渐成为热点,但是在丝状真菌中还鲜有报道。研究还鉴定了Fng3与NuA3乙酰化复合体/Rpd3去乙酰化复合体互作的特异结构区,揭示了决定其与不同复合体互作的序列基础,并基于此探究了Fng3在调控组蛋白乙酰化和去乙酰化动态平衡中的关键作用。该研究发现丝状真菌的生长抑制因子与组蛋白修饰之间存在独特的互作与调控模式,为认识不同组蛋白修饰间的关系提供了新见解。
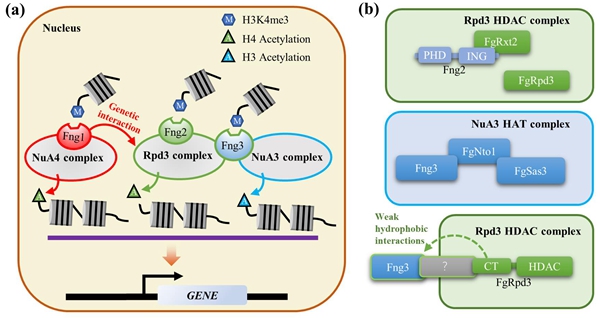
图7 赤霉菌ING蛋白参与调控组蛋白乙酰化模式图
该研究得到了国家、陕西省有关项目资助。
文章链接:https://nph.onlinelibrary.wiley.com/doi/abs/10.1111/nph.18294
编辑:王学锋
终审:徐海
