动科学院张智英教授团队在原核Argonaute蛋白研究方面取得重要进展
近日,动科学院张智英教授团队在原核Argonaute蛋白在体内环境(in vivo)具有DNA干扰属性的研究取得重要进展。研究论文以“Prokaryotic Argonaute Protein from Natronobacteriumgregoryi Requires RNAs To Activate for DNA Interference In Vivo”为题在《mBio》上发表。动科学院博士毕业生邢佳妮和在读博士生麻丽霞为共同第一作者,张智英教授和加拿大韦仕敦大学Joe S. Mymryk教授为共同通讯作者。
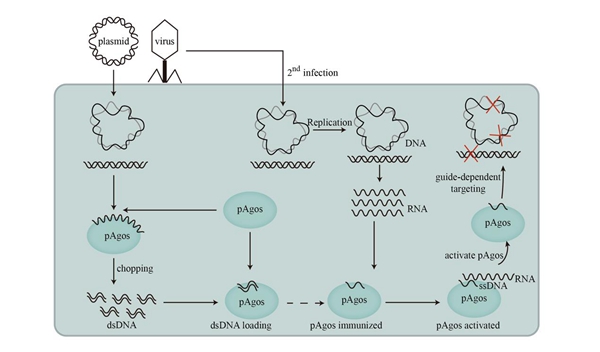
由于原核Argonaute蛋白在体外条件下具有切割DNA或RNA的能力,使其有望被开发成为新一代“人工核酸酶”,从而被用于基因组编辑。目前关于原核Argonaute蛋白的研究虽然十分热门,但是证明Argonaute在体内(in vivo)具有“核酸酶”功能的研究成果几乎一片空白。张智英教授团队多年来从事基因编辑研究,并致力于在体内研究原核Argonaute蛋白的功能和工作机制,发现NgAgo在大肠杆菌细胞内可以由特定的RNA激活其核酸酶活性,从而靶向切割质粒DNA导致其线性化;并在基因组和质粒DNA的同源序列之间形成DNA干扰,以消除外源DNA产量;并进一步利用T7噬菌体证实NgAgo及其突变体蛋白可以显著保护大肠杆菌细胞不被T7噬菌体裂解,同时破坏噬菌体基因组DNA为细菌提供免疫防御系统。以上结果都表明原核Argonaute蛋白作为原核生物的固有的防御系统以行使其生理功能。
该研究阐述了原核Argonaute蛋白在细菌细胞内的作用机理,解决了数十年来原核Argonaute蛋白研究领域的难题,并首次在细菌细胞内实现利用NgAgo蛋白切割DNA。该研究创新性地提出NgAgo蛋白作为原核生物防御机制的“监视”假说:原核Argonaute蛋白被外源核苷酸(例如病毒或质粒)启动子的转录产物激活并靶向清除外源核苷酸以防御病毒和外源DNA的入侵。本研究为今后将原核Argonaute蛋白开发成为替代CRISPR/Cas9的新一代基因编辑工具奠定了重要的理论基础。
该研究成果受到国家有关项目的资助。
原文链接:https://journals.asm.org/doi/10.1128/mbio.03656-21
编辑:张晴
终审:徐海
